| Natureduca - Portal educativo de ciencia y cultura |

Química
LOS COMPUESTOS DEL CARBONO
Estructura de los hidrocarburos - 2ª parte
Enlaces  y enlaces
y enlaces

 la vista de la forma en la que los enlaces se representan en
las fórmulas químicas puede pensarse que los diferentes enlaces de una unión
múltiple entre dos átomos de carbono son equivalentes. Sin embargo, tanto la
observación experimental como los resultados de la teoría del enlace químico
indican que ello no es así; los dos enlaces de una unión doble no tienen la
misma fuerza, uno se asemeja al de la unión simple carbono-carbono y recibe el
nombre de enlace
la vista de la forma en la que los enlaces se representan en
las fórmulas químicas puede pensarse que los diferentes enlaces de una unión
múltiple entre dos átomos de carbono son equivalentes. Sin embargo, tanto la
observación experimental como los resultados de la teoría del enlace químico
indican que ello no es así; los dos enlaces de una unión doble no tienen la
misma fuerza, uno se asemeja al de la unión simple carbono-carbono y recibe el
nombre de enlace
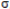 ; el otro es
más frágil y se denomina enlace
; el otro es
más frágil y se denomina enlace
 .
.
 con los átomos de H
y entre los átomos de C; el solapamiento lateral de las segundas produce el
enlace
con los átomos de H
y entre los átomos de C; el solapamiento lateral de las segundas produce el
enlace
 más débil.
más débil.
El solapamiento frontal entre dos lóbulos, uno
de cada átomo de carbono del primer grupo, da
lugar a un tipo de enlace denominado
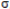 mientras que el solapamiento lateral de las nubes activas del segundo grupo da
lugar a un enlace
mientras que el solapamiento lateral de las nubes activas del segundo grupo da
lugar a un enlace 

 y los enlaces
y los enlaces
 ambas estructuras
se podrían representar como en la figura adjunta. Las nubes electrónicas
activas, cuyo solapamiento frontal genera los enlaces s, están todas en un mismo
plano, lo que da lugar a una estructura plana formando un hexágono regular. Las
nubes electrónicas cuyo solapamiento lateral produce los enlaces
ambas estructuras
se podrían representar como en la figura adjunta. Las nubes electrónicas
activas, cuyo solapamiento frontal genera los enlaces s, están todas en un mismo
plano, lo que da lugar a una estructura plana formando un hexágono regular. Las
nubes electrónicas cuyo solapamiento lateral produce los enlaces
 se encuentran en un
plano perpendicular al de la molécula.
se encuentran en un
plano perpendicular al de la molécula.Aun cuando las estructuras de partida parecen distinguir entre los enlaces dobles y los sencillos en la molécula de benceno, observaciones experimentales han puesto de manifiesto que la longitud de los diferentes enlaces C ---- C es idéntica e igual a 1,39 Å, es decir, intermedia entre la de un enlace sencillo (1,54 Å) y uno doble (1,34 Å).
Estudios teóricos refuerzan la idea de que en el benceno se produce un soIapamiento lateral generalizado de las nubes situadas en planos perpendiculares al de la molécula, lo que se traduce en sendos anillos superior e inferior. Eso significa que los electrones que participan en los enlaces p están deslocalizados, es decir, no pueden ser asignados a ningún par de átomos en concreto. Esta deslocalización da lugar a una importante disminución en la energía potencial de la molécula, lo que explica la considerable estabilidad química de este compuesto orgánico y de sus análogos.



